Ellen Berggreen og Anca Virtej
Pulpa og væskedrenasje. Hva vet vi nå og hva kan det bety i klinikken?
Professor. Institutt for biomedisin, det medisinske fakultet, Universitetet i Bergen og Tannhelsetjenestens kompetansesenter Vestland
Postdoktor. Kjevekirurgisk avdeling, Haukeland universitetssjukehus og Institutt for klinisk odontologi, Det medisinske fakultet, Universitetet i Bergen
Hovedbudskap
Pulpa er ett av noen få organer i kroppen uten lymfekar
Væsketransport i og ut av pulpa må foregå ved transport i løst bindevev
Lymfekar er lokalisert i bein i nærheten av periodontalligamentet i apikalområdet.
Tyggetrykk bidrar trolig til å øke væsketransport og drenasje
Ved aldring blir pulpa mer fibrotisk, noe som hemmer væsketransport i vevet og som trolig bidrar til økt sårbarhet for nekroseutvikling
Pulpa er omgitt av stivt hardvev og når væskevolumet øker, som ved en inflammasjon, vil også vevstrykket umiddelbart stige. For å kunne normalisere væskenivå er det derfor nødvendig å ha et drenasjesystem. I mange år har det vært diskutert om det finnes lymfekar i pulpa og ny forskning har vist at pulpa og periodontalligamentet (PDL) er et av få vev i kroppen uten lymfekar. Basert på denne kunnskap diskuterer vi her hvordan væske kan transporteres i pulpa, til periodontalligamentet og videre til opptak i sirkulasjonssystemet.
For å kunne transportere væske i pulpavevet må det være en trykkgradient for å flytte væske i det løse bindevevet pulp har. Trolig flytter væsken seg raskest langs blodkar og nerve-fibre i paravaskulære «spalter» i vevet hvor motstand mot væsketransport er minst. Væsken føres ut av apeks og videre gjennom periodontalligamentet og inn i bein hvor en finner lymfekar. Frem til lymfekarene vil væsken trolig følge paravaskulære «spalter» langs blodkar og nerver også utenfor pulpa. I underkjeven transporteres væsken inn i mandibularkanalen som også inneholder lymfekar. Det er sannsynlig at tyggetrykk vil øke væsketransporten og at tygging gir en pumpefunksjon som fremmer transport. Lymfekarene åpnes opp når vevstrykket øker og væske tas da opp i lymfekarene.
I den aldrende pulpa får vi fibroseutvikling som gir redusert væsketransport og drenasjekapasitet i vevet. Dette vil kunne hemme utvasking av ev. skadelig agens og bidra til en forlenget inflammatorisk respons med forhøyet vevstrykk. Pulpa er derfor trolig mer utsatt for å utvikle sirkulasjonssvikt enn organer med lymfekar.
Ved akutt apikal periodontitt spres betennelsesprodukter og bakteriekomponenter seg til regionale lymfeknuter via lymfekar lokalisert i kjevebeinet.
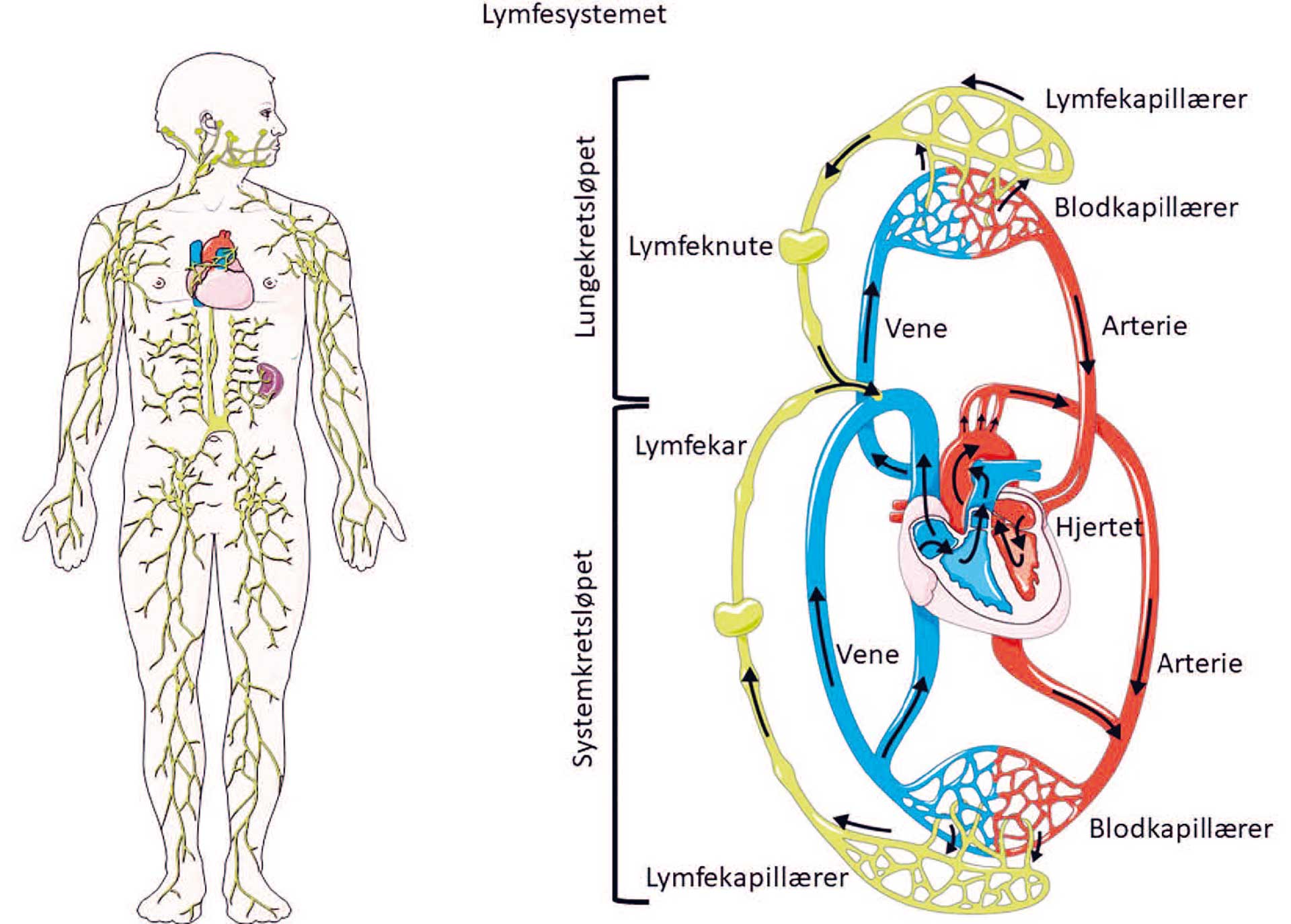
Figur 1. Skjematisk oversikt over kroppens lymfekar (venstre del av bilde). Blind-endede lymfekapillærer transporterer væske fra bindevevet og returnerer væsken tilbake til sirkulasjonen gjennom ductus thoracicus i vena jugularis (høyre del av bilde). (Modifisert fra Lymphatic system Archives - Servier Medical Art – Creative Commons Licence)
Lymfekar og status i pulpa
Lymfekar er viktige for å fjerne proteinrik overskuddsvæske fra vevet og samtidig transportere immunceller til regionale lymfeknuter for å initiere immunsvar. Lymfekar starter som blind-endede kapillærer i bindevevet og som åpnes opp når vevstrykket rundt dem øker. Proteinrik vevsvæske transporteres da inn i lymfekapillærene som består av lymfeendotelceller. Væsken transporteres videre til større lymfekar som har muskelceller i veggen som kan kontrahere. Eksterne krefter som arteriell puls og muskelaktivitet bidrar og til lymfetransport i kroppen. Samtidig hindrer klaffer i de større lymfekarene retrograd væsketransport. Det har vært vanskelig å påvise lymfekar da vi tidligere ikke hadde spesifikke markører for dem, men etter hvert er det kommet flere markører som gjør det mulig å identifisere lymfeendotelceller og dermed lymfekarstrukturer. Lymfekarene i kroppen transporterer væske tilbake til sirkulasjonssystemet gjennom ductus thoracicus til vena subclavia i halsregionen (figur 1).
Det har pågått en diskusjon i mange år om hvorvidt en har lymfekar i pulpa og motstridende funn har vært rapportert (1-3). Vår og andres forskning har vist at pulpa er ett av organene i kroppen som ikke har lymfekar (4-6). Hjernen og øyet er andre eksempel på organer som mangler lymfekar (7, 8). Spørsmålet er da hvordan overskuddsvæske fjernes fra pulpa og hvor den blir tatt opp?
Her drøfter vi hvilke muligheter som finnes for væskedrenasje i og utenfor pulpa i lys av denne nye kunnskapen, og hvilke faktorer som kan påvirke drenasjen og diskutere hvilke kliniske implikasjoner det kan ha.
Pulpas sirkulasjon og væskebalanse
Pulpa er et løst bindevev med god blodforsyning. Bindevevets væskeinnhold er høyt og utgjør ca. 60 % av vevets våtvekt (9). Kapillærtettheten er størst i den koronale delen av pulpa (10) og normalt siver det litt proteinrik væske ut av kapillærene. For å opprettholde en normal væskebalanse og vevstrykk i pulpa må denne overskuddsvæsken fjernes. Ved en betennelsestilstand øker utsiving av væske med protein fra kapillærene og blodvolumet i pulpa øker fordi karene utvider seg. Dette gir lokalt en vevstrykkøkning (11) på grunn av vevets manglende mulighet for ekspansjon.. En vevstrykkstigning vil i seg selv bidra til å redusere videre filtrasjon ved å sette opp et mottrykk (11). Ved en lokalisert betennelsestilstand vil noe væske trolig kunne tas opp i omliggende kapillærer i ikke-inflammerte områder i pulpa (12). Den lokale trykkøkningen i den koronale delen vil også fremme transport av væske i bindevevet mot område med lavere trykk i rotpulpa. Fordi bindevevet i pulpa er så løst vil væske lett kunne flyte gjennom vevet (13). Ved en betennelse vil temperaturen i pulpa stige, og dette fremmer ytterligere væsketransport i bindevevet (14).

Figur 2. Lymfekar (pil) i mandibularkanalen hos rotte i nær relasjon til nervebunter. I øvre del sees apeks på molarer. PDL: periodontalligament.
En annen faktor som også vil bidra til å øke væsketranssport er at pulpa hele tiden pulserer (15) som en konsekvens av den er omsluttet av hardvev og ikke kan ekspandere ved volumøkning. Ved en inflammasjon vil pulsasjonstrykket øke ytterligere. Den proteinrike væsken vil strømme ned i rotpulpa og nå apeks og vil derfra kunne passere ut i periodontalligamentet (PDL).
Det er sannsynlig at væsken følger det som i andre vev beskrives som «spalter» i vevet hvor væsketransporten er ekstra rask og hvor både blodkar og nerver løper. I disse paravaskulære transportveiene eller «spaltene» er det mindre motstand mot væsketransport. Dette er blant annet beskrevet i hjernen og i øyet og kalles et glymfatisk system (7, 8) hvor lymfekar mangler og væsketransport skjer i «spalter». Heyeraas og medarbeidere foreslo i 1994 at proteiner beveger seg i «spalter» i pulpa da det ble observert at radioaktivt protein beveget seg raskt fra den koronale del til det apikale området hvor det samlet seg langs nervefibre, men ikke i karstrukturer (16).
Når den proteinrike væsken beveger seg gjennom apeks kommer den til det apikale PDL, men heller ikke her finnes det lymfekar som kan absorbere væsken og føre den tilbake til sirkulasjonssystemet (17).
Nylig er det påvist lymfekar i bein (hos rotte) like under det apikale PDL (18) (figur 2) og i mandibularkanalen er det påvist lymfekarstrukturer nær blodkar og nervefibre (6, 18) (figur 2).
Ved tygging øker vevstrykket i PDL og det bidrar trolig til å skyve væske mot lymfekar som ligger i bein, og i underkjeven inn i mandibularkanalen. Dette gir en pumpeeffekt ved tygging med vekslende over og undertrykk i PDL som vil kunne bidra til økt væsketransport fra apikalområdet.
I en dyrestudie er det vist at proteinrik væske forflytter seg fra apikalområdet til vevet i mandibularkanalen, som er et løst bindevev (18). Utvaskingen fra mandibularkanalen er langsom og væske ble funnet i lymfeknuter og i blodbanen timer senere. Trolig skyldes den sene utvaskingen at det ikke er mulig å komprimere vevet i kanalen som er omgitt av bein. I andre områder av kroppen vil lymfetransport fremmes ved bevegelse og aktivering av muskelgrupper. Studien (18) viste at væske i mandibularkanalen ble drenert både via absorbsjon i blodkar og i lymfekar. Når vi tygger og væske skyves inn i kanalen vil det oppstå en trykkøkning som vil bidra til å åpne de blind-endede lymfekapillærene og gjøre at lymfetransporten ut av vevet øker. Væske og immunceller transporteres da til regionale lymfeknuter hvor antigenpresentasjon og immuncelleaktivering skjer.
Kliniske implikasjoner
Vi vet fra klinikken at en pulpitt kan reverseres gitt at vi for eksempel erstatter en fylling som lekker eller ved å fjerne karies og legge en tett fylling. Væskebalansen har da blitt normalisert og inflammasjonsprodukter er fjernet. Men, det at vi ikke har lymfekar inne i pulpa bidrar trolig til å gjøre pulpa sårbar for sirkulasjonssvikt ved en inflammatorisk tilstand. Når vi blir eldre reduseres pulpakavum i størrelse, vevet blir mer fibrotisk og det inneholder færre blodkar (19). Blodgjennomstrømningen går derfor ned og dersom det utvikles inflammasjon i vevet vil overskuddsvæske vanskeligere kunne transporteres i vevet på grunn av fibrose. Redusert vevsareal og redusert antall blodkar gjør forholdene mindre gunstig for reabsorbsjon i kapillærer nær det inflammerte området i pulpa. En eldre pulpa vil derfor ha mindre mulighet til å gjenopprette væskebalanse og fjerne skadelig agens etter en inflammasjon enn en ung pulpa. Et trangere apikalt foramen vil ytterligere redusere mulighet for væsketransport ut av pulpa når vi eldes (19). Samlet kan dette være en grunn til at eldre pasienter har flere nekrotiske tenner enn de yngre (20). Sannsynligvis gjør fravær av lymfekar i pulpa at den blir mer sårbar for sirkulasjonssvikt ved aldring fordi væsketransport skjer i «spalter» i vevet som trolig blir mindre og færre når pulpavolumet reduseres.
En akutt apikal periodontitt gir betennelse i lokale lymfeknuter som blir forstørret og palpasjonsømme. Inflammasjons- og bakterieprodukter har da blitt transportert med lymfekar til lymfeknutene og gir en betennelsestilstand kalt lymfadenitt. Samtidig vil immunceller også tas opp i lymfekar og transporteres til lymfeknuter hvor de bidrar til immunsvar. Lymfekarene som er lokalisert i kjevene er derfor viktige for infeksjonsbekjempelse ved pulpal og periaapikal sykdom, og i tillegg for å opprettholde normal væskebalanse.
Referanser
Oehmke MJ, Knolle E, Oehmke HJ. Lymph drainage in the human dental pulp. Microsc Res Tech. 2003; 62: 187–91.
Marchetti C, Piacentini C. [Light microscopy and electron microscopy study of the lymphatic capillaries of human dental pulp]. Bull Group Int Rech Sci Stomatol Odontol. 1990; 33: 19-23.
Martin A, Gasse H, Staszyk C. Absence of lymphatic vessels in the dog dental pulp: an immunohistochemical study. J Anat. 2010; 217: 609-15.
Virtej A, Loes S, Iden O, Bletsa A, Berggreen E. Vascular endothelial growth factors signalling in normal human dental pulp: a study of gene and protein expression. Eur J Oral Sci. 2013; 121: 92-100.
Gerli R, Secciani I, Sozio F, Rossi A, Weber E, Lorenzini G. Absence of lymphatic vessels in human dental pulp: a morphological study. Eur J Oral Sci. 2010; 118(2): 110-7.
Lohrberg M, Wilting J. The lymphatic vascular system of the mouse head. Cell Tissue Res. 2016; 366: 667-77.
Wang X, Lou N, Eberhardt A, Yang Y, Kusk P, Xu Q, et al. An ocular glymphatic clearance system removes beta-amyloid from the rodent eye. Sci Transl Med. 2020; 12(536).
Iliff J, Simon M. CrossTalk proposal: The glymphatic system supports convective exchange of cerebrospinal fluid and brain interstitial fluid that is mediated by perivascular aquaporin-4. J Physiol. 2019; 597: 4417-9.
Bletsa A, Berggreen E, Fristad I, Tenstad O, Wiig H. Cytokine signalling in rat pulp interstitial fluid and transcapillary fluid exchange during lipopolysaccharide-induced acute inflammation. J Physiol. 2006; 573(Pt 1): 225-36.
Kim S, Schuessler G, Chien S. Measurement of blood flow in the dental pulp of dogs with the 133xenon washout method. Arch Oral Biol. 1983; 28: 501-5.
Heyeraas KJ, Berggreen E. Interstitial fluid pressure in normal and inflamed pulp. Crit Rev Oral Biol Med. 1999; 10: 328-36.
Heyeraas KJ, Kim S, Raab WH, Byers MR, Liu M. Effect of electrical tooth stimulation on blood flow, interstitial fluid pressure and substance P and CGRP-immunoreactive nerve fibers in the low compliant cat dental pulp. Microvasc Res. 1994; 47(3): 329-43.
Brown AC, Yankowitz D. Tooth Pulp Tissue Pressure and Hydraulic Permeability. Circ Res. 1964; 15: 42-50.
Van Hassel HJ, Brown AC. Effect of temperature changes on intrapulpal pressure and hydraulic permeability in dogs. Arch Oral Biol. 1969; 14: 301-15.
Berggreen E, Heyeraas KJ. The role of sensory neuropeptides and nitric oxide on pulpal blood flow and tissue pressure in the ferret. J Dent Res. 1999; 78: 1535-43.
Heyeraas KJ. Pulpal hemodynamics and interstitial fluid pressure: balance of transmicrovascular fluid transport. J Endod. 1989; 15(10): 468-72.
Virtej A, Loes SS, Berggreen E, Bletsa A. Localization and signaling patterns of vascular endothelial growth factors and receptors in human periapical lesions. J Endod. 2013; 39: 605-11.
Virtej A, Tenstad O, Wiig H, Berggreen E. Interstitial fluid drainage from rat apical area takes place via vessels in the mandibular canal. Eur J Oral Sci. 2020; 128: 190-5.
Morse DR. Age-related changes of the dental pulp complex and their relationship to systemic aging. Oral Surg Oral Med Oral Pathol. 1991; 72: 721-45.
Eriksen HM. Endodontology--epidemiologic considerations. Endod Dent Traumatol. 1991; 7: 189-95.
English summary
Berggreen E, Virtej A.
Fluid drainage from the pulp. A current update and clinical implications
Nor Tannlegeforen Tid. 2021; 131: 788-92.
In the dental pulp surrounded by rigid dentinal walls, an increase in fluid volume will be followed by a rapid increase in interstitial fluid pressure. To maintain pressure homeostasis a fluid drainage system is required. Recent work has shown that the dental pulp and apical periodontal ligament lack lymphatic vessels, and the questions are how the transport can take place inside the pulp and moreover where the lymphatic vessels draining fluid from the apical periodontal ligament are located.
The drainage of fluid within the pulp must be governed by a tissue pressure difference gradient (driving pressure) and the fluid is likely transported in loose connective tissue gaps surrounding vessels and nerve fibers. In inflammation some reabsorption of fluid into nearby blood vessels is likely. We suggest that aging of the pulp tissue characterized by fibrosis will reduce the draining capacity. The aging pulp is therefore more vulnerable to circulatory failure.
When the fluid leaves the pulp, it will follow the nerve bundles and vessels into the bone. Chewing may speed up the fluid transport by increasing/decreasing the fluid pressure in the periodontal ligament. In acute apical periodontitis inflammatory mediators and bacterial components can be spread to regional lymph nodes via lymphatic vessels inside the jawbone and cause lymphadenitis.
Korresponderende forfatter: Ellen Berggreen: ellen.berggreen@uib.no
Akseptert for publisering 19.04.2021.
Artikkelen har gjennomgått ekstern faglig vurdering.
Berggreen E, Virtej A. Pulpa og væskedrenasje. Hva vet vi nå og hva kan det bety i klinikken? Nor Tannlegeforen Tid. 2021; 131: 788–792
Norsk MeSH: Tannpulpa; Lymfeårer; Det glymfatiske system; Cellefysiologi
